生物大分子作为生物体内的天然功能成分,是一类具有重要价值的生物活性产物,由于其具有高的生物相容性、生物代谢性、低免疫原性、高靶向性等优点,已成为生物质资源研究以及先进生物治疗的研究重点。生物大分子药物主要包括功能性蛋白质(白蛋白、转铁蛋白、脂蛋白)、多糖(壳聚糖、透明质酸)以及脂类等,在人类对抗各种重大疾病或罕见疾病的过程中,生物大分子发挥着极为重要的作用。从1922年分离出胰岛素蛋白开始,到乙肝疫苗、胰岛素、HPV疫苗、siRNA、GLP-1、CTLA-4、PD-1的研发成功,生物大分子在重大疾病和罕见疾病中的应用越来越受到重视,并已经取得了显著的进步。但是,生物大分子作为新型活性分子应用于生物治疗具有非常大的挑战,包括生物大分子结构的特殊性与内在特点等,低生物利用度、低稳定性是制约生物大分子制药广泛应用的核心科学问题,同时实现靶向的细胞内大分子释放将具有更大的挑战。国内外学者在该领域开展了大量的研究工作,开发了多种基于生物大分子为运载目标的多功能纳米载药系统,在靶向治疗相关纳米药物的研发中具有重要意义。
近期,国际顶级期刊《Advanced Functional Materials》(先进功能材料)特邀我院郭俊凌教授对该重要领域进行总结以及提出前瞻性展望。题为“Nanocarrier-Mediated Cytosolic Delivery of Biopharmaceuticals”的论文由我院王晓玲副研究员(专职科研博士后)作为共同第一作者与哈佛大学、中国药科大学团队完成。本论文重点介绍了以生物大分子核心的多功能纳米载药系统的最新研究进展,主要包括细胞跨膜的靶向运输,报道了多种生物制药给药途径中的胞质传递途径,包括小泡介导途径、接触释放、膜间转移、膜融合、直接易位和膜破裂等。在该论文中,通过对纳米技术和生物大分子化学之间的界面作用进行讨论,突出强调了生物大分子细胞递送系统对该类重要生物质资源的高效利用的意义,以及个性化医学的重要意义以及未来挑战。

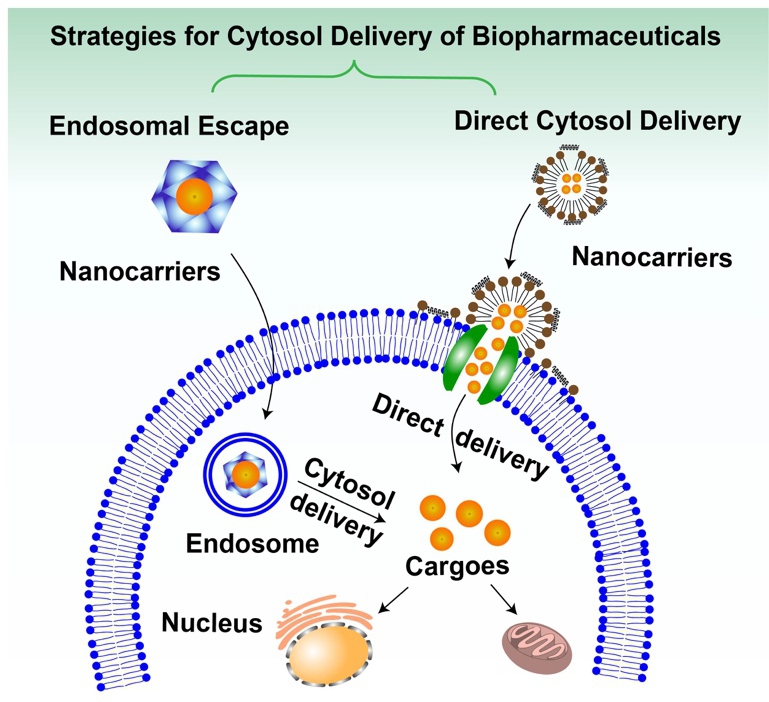
纳米载体通过溶酶体逃逸策略和非溶酶体途径将生物大分子递送进入细胞实现高效精准的生物大分子利用
该综述进一步阐述与传统的小分子药物相比,生物大分子具有较高的特异性和生物活性,因此在新药开发中具有广阔的前景。生物大分子结构的复杂性使其具有更强的特异性和功能效率,为传统的小分子疗法尚未解决、具有挑战性疾病的治疗提供了巨大的潜力。然而,生物大分子体积较大,例如,单克隆抗体(如IgG抗体,150 kDa)和重组蛋白(如重组蛋白A,39 kDa)比大多数小分子药物(如阿霉素,543.52 Da)大100多倍。这种大尺寸和分子复杂性通常导致大多数生物大分子制药的稳定性低,所以跨越不同水平的生物屏障(例如,皮肤、粘膜和细胞膜),将生物大分子递送到靶点一直是一个重大的挑战。
纳米载体给药是一种可以提高治疗效果的有效方式。首先,纳米颗粒可以通过内吞作用(包括吞噬作用、巨胞饮作用、网格蛋白和小窝蛋白介导的内吞作用)进入细胞,在这个过程中,细胞膜吞噬纳米颗粒并分裂后在细胞内形成一个独立的囊泡,随后释放生物大分子药物。其次,纳米颗粒可以增强内体逃逸能力,使生物大分子通过细胞溶质得到有效的传递,常用纳米颗粒包括脂质体和脂基NPs、聚合物胶束和聚合物NPs、脂-聚合物混合NPs、纳米晶体以及无机NPs,如金NPs、磁性NPs、碳纳米管、石墨烯、量子点和硅NPs。最后,纳米颗粒易实现胞内直接递送,主要途径包括小窝介导途径、接触释放和膜间转移、膜融合、胞内直接易位、膜破裂和显微注射。该综述对此详述了细胞内直接递送生物大分子策略以及它们的优缺点,以及这些策略解决胞浆递送的挑战。
该论文由我院“国家高层次人才计划”青年项目获得者郭俊凌教授课题组、美国工程院、美国医学院双院院士Samir Mitragotri教授团队合作完成,best365英国体育在线与哈佛大学为共同通讯单位。该论文在“国家高层次人才计划”青年项目、best365英国体育在线“双百”人才引进计划项目、国家“双一流”建设计划、美国国立卫生研究所基金共同资助完成。
原文可见:https://doi.org/10.1002/adfm.201910566 DOI: 10.1002/adfm.201910566